3 Teori Lengkap Asam Basa Menurut Para Ahli Beserta Contohnya
Ditulis pada: 5/23/2016
Kali ini kita akan membahas Teori Asam Basa Menurut Para Ahli disertai dengan contohnya, sebelumnya apakah anda tahu senyawa asam dalam kehidupan sehari-hari? Senyawa asam dalam kehidupan sehari-hari antara lain asam cuka, asam sitrat, dan asam sulfat.
Asam cuka biasanya digunakan untuk memasak makanan misalnya acar, asam sitrat dalam buah jeruk, dan asam sulfat digunakan dalam aki kendaraan bermotor.
 Selain asam ada senyawa basa seperti aluminium hidroksida dan magnesium hidroksida yang terdapat pada obt mag serta kalsium hidroksida atau air kapur.
Selain asam ada senyawa basa seperti aluminium hidroksida dan magnesium hidroksida yang terdapat pada obt mag serta kalsium hidroksida atau air kapur.
Ada beberapa teori yang membahas sifat asam dan sifat basa, antara lain teori asam-basa Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan lengkap mengenai teori-teori tersebut, silahkan simak baik-baik.
Pada tahun 1884, Svante August Arrhenius, seorang ahli kimia dari Swedia mengemukakan konsep asam dan basa.
Dia menjelaskan bagaimana kekuatan asam dalam air tergantung pada konsentrasi ion-ion hidrogen di dalamnya.
Menurut Arrhenius, asam adalah zat yang jika di dalam air melepaskan ion hidrogen (H+).

Contoh-contoh reaksi asam ketika dilarutkan dalam air sebagai yaitu sebagai berikut.
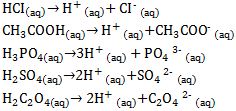
Sebenarnya ion-ion hidrogen yang dihasilkan oleh asam ketika dilarutkan dalam air terikat pada molekul-molekul air (H2O) dalam bentuk ion hidronium, yaitu ion positif yang dibentuk oleh penambahan sebuah proton (ion hidrogen) pada sebuah molekul air.
Ion ini dinyatakan dengan rumus kimia H3O+. Akan tetapi, seringkali kita hanya menulis dengan H+.
Tidak semua senyawa hidrogen adalah asam, misalnya etanol yang mempunyai rumus kimia C2H5OH. Walaupun ada unsur H-ya, etanol bukan asam.
Begitu juga tidak semua hidrogen pada rumus kimia suatu asam dapat dilepaskan sebagai ion H+ dalam larutan.
Contohnya, dalam rumus kimia asam asetat terdapat empat atom hidrogen, tetapi satu atom H saja yang dapat dilepaskan sebagai ion H+.

Asam asetat merupakan asam lemah karena yang terisonisasi sangat sedikit.
Berdasarkan kekuatannya, asam terdiri atas asam kuat dan asam lemah yang ditentukan oleh besarnya derajat ionisasi di dalam larutan air.
Asam kuat adalah asam yang derajat ionisasinya mendekati satu asam yang mengalami ionisasi sempurna.
Contohnya HCI (asam klorida), HBr (asam bromida), HI (asam iodida), HNO3 (asam nitrat), H2SO3 (asam sulfit), H3PO4 (asam fosfat) dan H2CO3 (asam karbonat).
Asam lemah adalah asam yang derajat ionisasinya lebih kecil atau asam yang mengalami ionisasi sebagian.
Contoh HF (assam fluorida), CH3COOH (asam asetat), HCN (asam sianida), HNO2 (asam nitrit), H2SO3 (asam sulfit), H3PO4 (asam fosfat), dan H2CO3 (asam karbonat).
Berdasarkan jumlah ion H+ yang dilepaskan, asam dibedakan sebagai berikut:
Asam monoprotik adalah asam yang melepaskan satu ion H+ dalam pelarut air.
Contoh:
Asam diprotik adalah asam yang melepaskan dua ion H+ dalam pelarut air.
Contoh: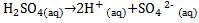
Asam triprotik adalah asam yang melepaskan tiga ion H+ dalam pelarut air.
Contoh: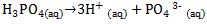
Ion negatif yang terbentuk dari asam setelah melepas ion H+ disebut ion sisa asam.
Menurut Arrhenius, basa adalah senyawa yang dalam air dapat menghasilkan ion hidroksida (OH-).
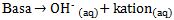
Contoh-contoh reaksi basa ketika dilarutkan dalam air sebagai berikut.
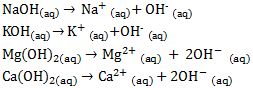
Basa berdasarkan pada ion OH- yang dilepaskan pada reaksi ionisasi basa dibedakan menjadi sebagai berikut:
Basa monohidroksi adalah basa yang pada reaksi ionisasi melepaskan satu ion OH-.
Contoh:
Basa polihidroksi adalah basa yang ada pada reaksi ionisasi melepaskan ion OH- lebih dari satu.
Contoh:

Teori asam-basa Bronsted-Lowry adalah teori yang melengkapi kelemahan teori asam-basa Arrhenius karena tidak semua senyawa bersifat asam/basa dapat menghasilkan ion H+/OH- jika dilarutkan dalam air.
Menurut Bronsted-Lowry asam adalah senyawa yang dapat menyumbang proton, yaitu ion H+ ke senyawa/zat lain.
Basa adalah senyawa yang dapat menerima proton, yaitu ion H+ dari senyawa/zat lain. Teori ini juga memiliki kelemahan, yaitu tidak dapat memperlihatkan sifat asam/basa suatu senyawa jika tidak ada proton yang terlibat dalam reaksi.
Berdasarkan teori di atas, reaksi antara gas HCI dan NH3 dapat dijelaskan sebagai reaksi asam-basa yaitu:

Simbol (g) dan (s) menyatakan zat berwujud gas dan padat. Hidrogen klorida mendonorkan proton pada amonia dan berperan sebagai asam.
Menurut teori Bronsted dan Lowry, zat dapat berperan baik sebagai asam maupun basa. Jika zat tertentu lebih mudah melepas proton, zat ini akan berperan sebagai asam dan lawannya sebagai basa.
Sebaliknya, jika suatu zat lebih mudah menerima proton, zat ini akan berperan sebagai basa. Dalam suatu larutan asam dalam air, air berperan sebagai basa.

Dalam reaksi diatas, perbedaan HCI dan CI- adalah sebuah proton, dan perubahan antarkeduanya adalah reversibel.
Hubungan seperti ini disebut hubungan konjugat, serta pasangan HCI dan CI- juga disebut pasangan asam-basa konjugat.
Larutan dalam air ion CO32 bersifat basa. Dalam reaksi antara ion CO32- dan H2O, yang pertama berperan sebagai basa dan yang kedua sebagai asam dan keduanya membentuk pasangan asam-basa konjugat.

Zat disebut sebagai amfoter bila zat ini dapat berperan sebagai asam atau basa. Air adalah zat atmosfer yang khas. Reaksi antara dua molekul air menghasilkan ion hidronium dan ion hidroksida adalah contoh khas reaksi zat atmosfer.

Di tahun 1923 ketika Bronsted dan Lowry mengusulkan teori asam-basanya, Lewis mengusulkan teori asam-basa baru juga.
Lewis yang juga mengusulkan teori oktet, memikirkan bahwa teori asam-basa sebagai masalah dasar yang harus diselesaikan berlandaskan teori struktur atom, bukan berdasarkan hasil percobaan.
Menurut Lewis, asam adalah zat yang dapat menerima elektron. Basa adalah zat yang dapat mendonorkan pasangan elektron.
Semua zat yang didefinisikan sebagai asam dalam teori Arrhenius juga merupakan asam dalam kerangka teori Lewis, karena proton adalah aksepator pasangan elektron.
Dalam reaksi netralis proton membentuk ikatan koordinat dengan ion hidroksida.

Situasi ini sama dengan reaksi fase gas yang pertama diterima sebagai reaksi asam-basa dalam kerangka teori Bronsted-Lowry.

Dalam reaksi ini proton dan HCI membentuk ikatan koordinat dengan pasangan elektron bebas atom nitrogen.
Keuntungan utama teori asam-basa Lewis terletak pada fakta bahwa beberapa reaksi yang tidak dianggap sebagai reaksi asam-basa dalam kerangka teori Arrhenius dan Bronstred-Lowry terbukti sebagai reaksi asam-basa dalam teori Lewis.
Sebagai contoh reaksi antara boron trifluorida BF3 dan ion fluorida F-.

Reaksi ini melibatkan koordinasi boron trifluorida pada pasangan elektron bebas ion fluorida. Menurut teori asam-basa Lewis, BF3 adalah asam.
Untuk membedakan asam semacam BF3 dari asam protik (yang melepas proton dengan kata lain, asam adalah kerangka teori Arrhenius dan Bronsted-Lowry), asam ini disebut asam Lewis.
Boron membentuk senyawa yang tidak memenuhi aturan oktet, dan dengan demikian adalah contoh khas unsur yang membentuk asam Lewis.
Karena semua basa bronsted-Lowry mendonasikan pasangan elektronnya pada proton, basa ini juga merupakan basa Lewis.
Namun, tidak semua asam Lewis adalah asam Bronsted-Lowry sebagaimana dinyatakan dalam contoh diatas.
Dari ketiga definisi asam-basa di atas, definisi Arrhenius yang paling terbatas. Teori Lewis meliputi asam-basa yang paling luas.
Sepanjang yang dibahas adalah reaksi di larutkan dalam air, teori Bronsted-Lowry paling mudah digunakan, tetapi teori Lewis lah yang paling tepat bila reaksi asam-basa melibatkan senyawa tanpa proton.
Nah demikianlah pembahasan kita mengenai 3 Teori Lengkap Asam Basa Menurut Para Ahli Beserta Contohnya, semoga bisa bermanfaat bagi semua orang dan semoga dapat dipahami dengan mudah.
Asam cuka biasanya digunakan untuk memasak makanan misalnya acar, asam sitrat dalam buah jeruk, dan asam sulfat digunakan dalam aki kendaraan bermotor.

Ada beberapa teori yang membahas sifat asam dan sifat basa, antara lain teori asam-basa Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan lengkap mengenai teori-teori tersebut, silahkan simak baik-baik.
1. Teori Asam Basa Arrhenius
Pada tahun 1884, Svante August Arrhenius, seorang ahli kimia dari Swedia mengemukakan konsep asam dan basa.
Dia menjelaskan bagaimana kekuatan asam dalam air tergantung pada konsentrasi ion-ion hidrogen di dalamnya.
Asam
Menurut Arrhenius, asam adalah zat yang jika di dalam air melepaskan ion hidrogen (H+).

Contoh-contoh reaksi asam ketika dilarutkan dalam air sebagai yaitu sebagai berikut.
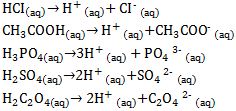
Sebenarnya ion-ion hidrogen yang dihasilkan oleh asam ketika dilarutkan dalam air terikat pada molekul-molekul air (H2O) dalam bentuk ion hidronium, yaitu ion positif yang dibentuk oleh penambahan sebuah proton (ion hidrogen) pada sebuah molekul air.
Ion ini dinyatakan dengan rumus kimia H3O+. Akan tetapi, seringkali kita hanya menulis dengan H+.
Tidak semua senyawa hidrogen adalah asam, misalnya etanol yang mempunyai rumus kimia C2H5OH. Walaupun ada unsur H-ya, etanol bukan asam.
Begitu juga tidak semua hidrogen pada rumus kimia suatu asam dapat dilepaskan sebagai ion H+ dalam larutan.
Contohnya, dalam rumus kimia asam asetat terdapat empat atom hidrogen, tetapi satu atom H saja yang dapat dilepaskan sebagai ion H+.

Asam asetat merupakan asam lemah karena yang terisonisasi sangat sedikit.
Berdasarkan kekuatannya, asam terdiri atas asam kuat dan asam lemah yang ditentukan oleh besarnya derajat ionisasi di dalam larutan air.
[1] Asam Kuat
Asam kuat adalah asam yang derajat ionisasinya mendekati satu asam yang mengalami ionisasi sempurna.
Contohnya HCI (asam klorida), HBr (asam bromida), HI (asam iodida), HNO3 (asam nitrat), H2SO3 (asam sulfit), H3PO4 (asam fosfat) dan H2CO3 (asam karbonat).
[2] Asam Lemah
Asam lemah adalah asam yang derajat ionisasinya lebih kecil atau asam yang mengalami ionisasi sebagian.
Contoh HF (assam fluorida), CH3COOH (asam asetat), HCN (asam sianida), HNO2 (asam nitrit), H2SO3 (asam sulfit), H3PO4 (asam fosfat), dan H2CO3 (asam karbonat).
Berdasarkan jumlah ion H+ yang dilepaskan, asam dibedakan sebagai berikut:
[1] Asam Monoprotik
Asam monoprotik adalah asam yang melepaskan satu ion H+ dalam pelarut air.
Contoh:

[2] Asam Diprotik
Asam diprotik adalah asam yang melepaskan dua ion H+ dalam pelarut air.
Contoh:
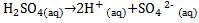
[3] Asam Triprotik
Asam triprotik adalah asam yang melepaskan tiga ion H+ dalam pelarut air.
Contoh:
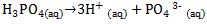
Ion negatif yang terbentuk dari asam setelah melepas ion H+ disebut ion sisa asam.
Basa
Menurut Arrhenius, basa adalah senyawa yang dalam air dapat menghasilkan ion hidroksida (OH-).
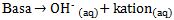
Contoh-contoh reaksi basa ketika dilarutkan dalam air sebagai berikut.
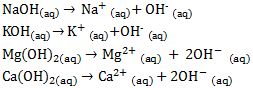
Basa berdasarkan pada ion OH- yang dilepaskan pada reaksi ionisasi basa dibedakan menjadi sebagai berikut:
[1] Basa Monohidroksi
Basa monohidroksi adalah basa yang pada reaksi ionisasi melepaskan satu ion OH-.
Contoh:

[2] Basa Polihidroksi
Basa polihidroksi adalah basa yang ada pada reaksi ionisasi melepaskan ion OH- lebih dari satu.
Contoh:

2. Teori Asam Basa Menurut Bronsted-Lowry
Teori asam-basa Bronsted-Lowry adalah teori yang melengkapi kelemahan teori asam-basa Arrhenius karena tidak semua senyawa bersifat asam/basa dapat menghasilkan ion H+/OH- jika dilarutkan dalam air.
Menurut Bronsted-Lowry asam adalah senyawa yang dapat menyumbang proton, yaitu ion H+ ke senyawa/zat lain.
Basa adalah senyawa yang dapat menerima proton, yaitu ion H+ dari senyawa/zat lain. Teori ini juga memiliki kelemahan, yaitu tidak dapat memperlihatkan sifat asam/basa suatu senyawa jika tidak ada proton yang terlibat dalam reaksi.
Berdasarkan teori di atas, reaksi antara gas HCI dan NH3 dapat dijelaskan sebagai reaksi asam-basa yaitu:

Simbol (g) dan (s) menyatakan zat berwujud gas dan padat. Hidrogen klorida mendonorkan proton pada amonia dan berperan sebagai asam.
Menurut teori Bronsted dan Lowry, zat dapat berperan baik sebagai asam maupun basa. Jika zat tertentu lebih mudah melepas proton, zat ini akan berperan sebagai asam dan lawannya sebagai basa.
Sebaliknya, jika suatu zat lebih mudah menerima proton, zat ini akan berperan sebagai basa. Dalam suatu larutan asam dalam air, air berperan sebagai basa.

Dalam reaksi diatas, perbedaan HCI dan CI- adalah sebuah proton, dan perubahan antarkeduanya adalah reversibel.
Hubungan seperti ini disebut hubungan konjugat, serta pasangan HCI dan CI- juga disebut pasangan asam-basa konjugat.
Larutan dalam air ion CO32 bersifat basa. Dalam reaksi antara ion CO32- dan H2O, yang pertama berperan sebagai basa dan yang kedua sebagai asam dan keduanya membentuk pasangan asam-basa konjugat.

Zat disebut sebagai amfoter bila zat ini dapat berperan sebagai asam atau basa. Air adalah zat atmosfer yang khas. Reaksi antara dua molekul air menghasilkan ion hidronium dan ion hidroksida adalah contoh khas reaksi zat atmosfer.

3. Teori Asam Basa Menurut Lewis
Di tahun 1923 ketika Bronsted dan Lowry mengusulkan teori asam-basanya, Lewis mengusulkan teori asam-basa baru juga.
Lewis yang juga mengusulkan teori oktet, memikirkan bahwa teori asam-basa sebagai masalah dasar yang harus diselesaikan berlandaskan teori struktur atom, bukan berdasarkan hasil percobaan.
Menurut Lewis, asam adalah zat yang dapat menerima elektron. Basa adalah zat yang dapat mendonorkan pasangan elektron.
Semua zat yang didefinisikan sebagai asam dalam teori Arrhenius juga merupakan asam dalam kerangka teori Lewis, karena proton adalah aksepator pasangan elektron.
Dalam reaksi netralis proton membentuk ikatan koordinat dengan ion hidroksida.

Situasi ini sama dengan reaksi fase gas yang pertama diterima sebagai reaksi asam-basa dalam kerangka teori Bronsted-Lowry.

Dalam reaksi ini proton dan HCI membentuk ikatan koordinat dengan pasangan elektron bebas atom nitrogen.
Keuntungan utama teori asam-basa Lewis terletak pada fakta bahwa beberapa reaksi yang tidak dianggap sebagai reaksi asam-basa dalam kerangka teori Arrhenius dan Bronstred-Lowry terbukti sebagai reaksi asam-basa dalam teori Lewis.
Sebagai contoh reaksi antara boron trifluorida BF3 dan ion fluorida F-.

Reaksi ini melibatkan koordinasi boron trifluorida pada pasangan elektron bebas ion fluorida. Menurut teori asam-basa Lewis, BF3 adalah asam.
Untuk membedakan asam semacam BF3 dari asam protik (yang melepas proton dengan kata lain, asam adalah kerangka teori Arrhenius dan Bronsted-Lowry), asam ini disebut asam Lewis.
Boron membentuk senyawa yang tidak memenuhi aturan oktet, dan dengan demikian adalah contoh khas unsur yang membentuk asam Lewis.
Karena semua basa bronsted-Lowry mendonasikan pasangan elektronnya pada proton, basa ini juga merupakan basa Lewis.
Namun, tidak semua asam Lewis adalah asam Bronsted-Lowry sebagaimana dinyatakan dalam contoh diatas.
Kesimpulan
Dari ketiga definisi asam-basa di atas, definisi Arrhenius yang paling terbatas. Teori Lewis meliputi asam-basa yang paling luas.
Sepanjang yang dibahas adalah reaksi di larutkan dalam air, teori Bronsted-Lowry paling mudah digunakan, tetapi teori Lewis lah yang paling tepat bila reaksi asam-basa melibatkan senyawa tanpa proton.
Nah demikianlah pembahasan kita mengenai 3 Teori Lengkap Asam Basa Menurut Para Ahli Beserta Contohnya, semoga bisa bermanfaat bagi semua orang dan semoga dapat dipahami dengan mudah.