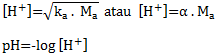Indikator, Derajat Keasaman, dan Tetapan Kesetimbangan
Ditulis pada: 5/24/2016
Halo teman-teman kali ini kita akan membahas IPA kimia mengenai Indikator, Derajat Keasaman, dan Tetapan Kesetimbangan yang akan dibahas dengan lengkap dengan contoh soal, agar teman-teman dapat memahaminya dengan baik. Tidak perlu panjang lebar mari kita simak penjelasannya dibawah ini.









1. Indikator
Apa itu indikator? Indikator adalah zat yang dapat menunjukkan suatu larutan bersifat asam atau basa. Metode pengukuran pH selain menggunakan perhitungan juga dapat menggunakan indikator loh.
a. Indikator Asam Basa
Untuk mengenali suatu zat apakah bersifat asam atau basa kita tidak boleh mencicipi atau memegangnya, emang kenapa kalau dipegang atau dicicipi? karena itu akan sangat berbahaya.
Contohnya asam sulfat (H2SO4), yang dalam kehidupan sehari-hari dipakai sebagai accu zuur (air kaki).Bila tangan atau kulit terkena asam sulfat maka akan melepuh seperti luka bakar dan jika terkena mata akan mengakibatkan kebutaan.
Natrium hidroksida (NaOH) merupakan basa yang sering digunakan untuk membersihkan saluran air bak cuci. Bila tangan atau kulit terkena natrium hidroksida maka akan terasa gatal-gatal dan tangan akan mudah terluka atau iritasi.
Jadi, bagaimana cara mengenali zat yang bersifat asam atau bersifat basa? Cara yang tepat untuk menentukan sifat asam atau basa adalah dengan menggunakan zat petunjuk yang disebut indikator. Indikator asam basa adalah zat yang dapat berbeda warna jika berada pada lingkungan asam atau lingkungan basa.
Ada beberapa jenis indikator yang dapat digunakan untuk membedakan antara larutan yang bersifat asam dengan larutan yang bersifat basa, yaitu kertas lakmus dan larutan indikator.
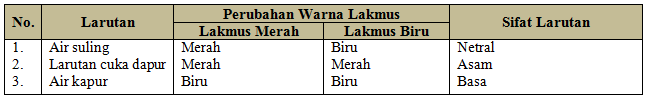
[1] Kertas Lakmus
Indikator yang sering digunakan di laboratorium kimia adalah kertas lakmus merah dan kertas lakmus biru. Berikut ini hasil pengujian pendahuluan terhadap kertas lakmus merah dan kertas lakmus biru pada larutan air suling, larutan cuka dapur, dan air kapur.
Tabel Perubahan Warna Kertas Lakmus pada Larutan Asam dan Basa

Tabel Pengujian Sifat Beberapa Larutan dengan Kertas Lakmus

[2] Larutan Indikator
Larutan indikator yang sering digunakan di laboratorium kimia adalah fenolftalein, metil merah, metil jingga, dan bromtimol biru. Berikut ini diberikan tabel pengujian perubahan warna larutan indikator dalam larutan asam dan larutan basa.
Tabel Perubahan Warna Indikator dalam Larutan Asam dan Larutan Basa

# Menggunakan Indikator Universal
Indikator universal adalah gabungan dari beberapa faktor. Ada yang berupa larutan, ada pula yang berupa kertas serap yang dikemas dalam kotak yang dilengkapi dengan peta warna. Penggunaan indikator yang berupa kertas serap sangat sederhana, yaitu dengan dicelupkan pada larutan atau ditetesi dengan larutan yang akan diukur pH-nya, kemudian bandingkan perubahan warna yang terjadi pada peta warna yang tersedia.
# Menggunakan pH Meter
pH meter adalah alat pengukur pH dengan ketelitian yang sangat tinggi. pH meter dapat menyatakan pH larutan sampai dua angka desimal pada temperatur tertentu. Cara menggunakan pH meter sangat sederhana yaitu dengan mencelupkan ke dalam larutan yang akan diperiksa dengan pH meter. Kemudian baca skala yang ditunjukkan oleh jarum atau angka pada pH meter tersebut.
# Indikator Alami
Di samping indikator lakmus, larutan indikator, indikator universal, dan pH meter, kita juga dapat mengenali senyawa asam atau basa dengan menggunakan indikator alami, seperti bunga sepatu, kunyit, kol merah, dan beberapa jenis tumbuhan lainnya.
2. Derajat Keasaman (pH)
Derajat keasaman dan kebasaan adalah bilangan yang menyatakan jumlah ion hidrogen (H+) dan jumlah ion hidroksil (OH-) dalam suatu zat. Nilai derajat keasaman dan kebasaan suatu zat tergantung pada jumlah ion H+ dan OH- di dalam air.
Semakin asam suatu zat, maka semakin banyak ion H+ dan semakin sedikit jumlah ion OH- di dalam air. Sebaliknya, semakin basa suatu zat, maka semakin sedikit jumlah ion H+ dan semakin banyak ion H- di dalam air. Jumlah ion H+ dan OH- di dalam air dinyatakan dengan pH atau pOH.
Derajat keasaman atau kebasaan suatu zat hanya dinyatakan dengan skala pH. Derajat keasaman suatu zat (pH) ditunjukkan dengan skala pH. Derajat keasaman suatu zat (pH) ditunjukkan dengan skala 0 - 14. Sifat asam atau basa ditentukan oleh skala pH sebagai berikut.
- Larutan dengan pH < 7 bersifat asam.
- Larutan dengan pH = 7 bersifat netral.
- Larutan dengan pH > 7 bersifat basa.
Semakin kecil nilai pH, maka zat tersebut semakin asam, sedangkan semakin besar nilai pH suatu zat maka zat tersebut semakin bersifat basa.
Analog di atas untuk OH-
pH = pKw - pOH
pH = 14 - pOH
a. pH Asam Kuat
b. pH Asam Lemah
c. pH Basa Kuat
d. pH Basa Lemah
3. Tetapan Kesetimbangan Air (Kw)
Air murni jika diukur daya hantar listrik nya dengan ampermeter yang peka merupakan zat elektrolit, tapi elektrolit sangat lemah dan memiliki hantaran listrik. Adanya hantaran ini menunjukkan adanya ion-ion di dalam air murni sebagai hasil ionisasi air.
Persamaan ionisasi air:

Karena berada dalam kesetimbangan maka:

Oleh karena konsentrasi ion H+ dan ion H- dalam air murni adalah sama besarnya, maka air bersifat netral. Jika keadaan air ditambah asam, maka asam tersebut akan melepaskan ion H+ yang berakibat konsentrasi ion H+ akan bertambah banyak sehingga akan mengganggu kesetimbangan air. Karena harga Kw tetap, akibatnya konsentrasi ion H- akan berkurang.
Sedangkan jika air ditambahkan ke dalamnya, maka basa tersebut akan terionisasi dengan melepaskan ion OH- akibatnya konsentrasi OH- dalam air akan menjadi lebih besar dan konsentrasi ion H+ akan berkurang.
Oleh Karena H2O dapat dianggap konstan, maka hasil kali Kc[H2O] adalah suatu konstanta yang disebut terapan kesetimbangan atau kesetimbangan air (Kw). Pada saat air dalam keadaan netral pH air = 7 sehingga didapatkan bahwa:

Harga Kw pada berbagai suhu adalah 

Tabel Kw pada Berbagai Suhu

# Contoh Soal dan Jawaban

Demikian lah pembahasan IPA Kimia kali ini mengenai Indikator, Derajat Keasaman, dan Tetapan Kesetimbangan, semoga artikel ini bisa bermanfaat bagi semua orang dan dapat membantu teman-teman belajar.